Un sistema gaseoso es un conjunto de partículas (átomos, moléculas o iones) que se encuentran en un estado de alta energía cinética y que se mueven en todas las direcciones de manera aleatoria.
Estas partículas están separadas entre sí por distancias relativamente grandes en comparación con su tamaño y se encuentran en constante colisión entre sí y con las paredes del recipiente que las contiene.
Las propiedades del sistema gaseoso, como la presión, el volumen, la temperatura y la cantidad de sustancia, se rigen por las leyes de la termodinámica y se pueden describir a través de modelos matemáticos, como la ley de los gases ideales. Los sistemas gaseosos son de gran importancia en la química, la física y la ingeniería, y se pueden encontrar en una amplia variedad de procesos y aplicaciones, desde la respiración y la combustión hasta la fabricación de productos químicos y la generación de energía.
Variables que afectan a un sistema gaseoso
Masa: se relaciona con la cantidad de materia o el número de partículas de gas, cuando el sistema gaseoso está cerrado no hay pérdida de materia por lo tanto ésta variable permanecerá constante.
Volumen: se relaciona con la distancia que existe entre las partículas de un gas, si estás se encuentran muy separadas, ocuparán más lugar y su volumen será mayor, está variable puede modificarse notablemente.
Temperatura: se relaciona con la energía cinética que poseen las partículas de un gas. Cuando la temperatura aumenta también lo hace la energía cinética y las partículas se mueven con mayor velocidad.
Presión: se relaciona con el número de colisiones o choques que ocurren entre las partículas de un gas contra las paredes del recipiente cuánto mayor sea la cantidad de choques mayor será la presión.
Expresiones de las unidades de la presión y la temperatura
En química es más común medir la presión en atmósferas (Atm) o mmHg (milimetros de mercurio)
1 atm = 760 mm hg = 1013
Temperatura
La escala más utilizada en nuestro país es la Celsius grados centígrados.
En el sistema internacional la unidad de temperatura es el Kelvin.
0 k = -273 °C (cero absoluto)
Leyes expermientales de los Gases Ideales
La ley experimental de los gases es una combinación de la ley de Charles, la ley de Boyle-Mariotte y la ley de Gay-Lussac. Estas leyes se refieren a cada una de las variables que son presión, volumen y temperatura absoluta.
Existe una relación entre la presión la temperatura y el volumen de un gas que se halla dentro de un recipiente cerrado
Primera ley experimental de los gases
A temperatura constante, el volumen de un gas es inversamente proporcional a la presión a la qué es sometido. Sí aumentamos la presión sobre un gas, sus partículas se acercan entre sí y su volumen disminuye proporcionalmente a la presión aplicada.
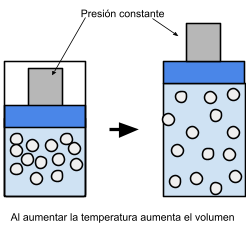
Segunda ley experimental de los gases
A presión constante el volumen de un gas es directamente proporcional a la temperatura a la qué es sometido.
Sí aumentamos la temperatura del gas, sus partículas se mueven a mayor velocidad, se alejan unas de otras y por lo tanto aumenta el volumen que ocupa proporcionalmente al aumento de temperatura.
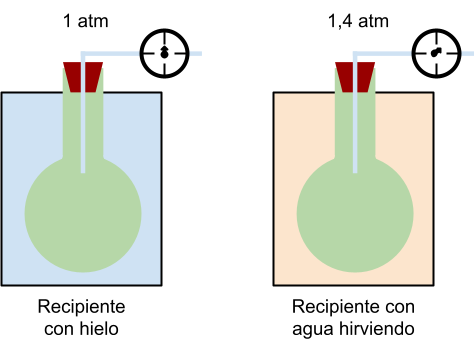
Tercera ley experimental de los gases
A volumen constante la presión de un gas es directamente proporcional a la temperatura a la qué es sometido
Sí aumentamos la temperatura del gas las partículas se mueven a mayor velocidad chocan con las paredes del recipiente y la presión que ejerce el gas aumenta de forma proporcional al aumento de temperatura.
Ecuación general de estado
P1.V1 /T1 = P2.V2 / T2